發佈於2018年4月8日
(來源:PRN-Physician Recommended Nutriceuticals®)
概要
• 血糖毛病影響胰腺,胰腺負責生產消化食物所需的酶。 最近的研究繼續證實,多達74%的血糖毛病人士俱有消化吸收脂肪能力受損。1
• 在人頫身體中發現最高Omega-3濃度的組織之一(特別是DHA),是在視網膜中。 豐富的文獻及經評審的數據支持Omega-3s – EPA / DHA作為一種醫療食品,以防止缺乏Omega-3脂肪酸的血糖影響眼睛健康高風險人士,發展至嚴重眼睛疾病,並阻止其病情亦壞.2
• 應鼓勵患有II型糖尿病但無糖尿病視網膜病變的患者每年進行一次擴張眼睛檢查以檢測糖尿病視網膜病變的發作。
背景
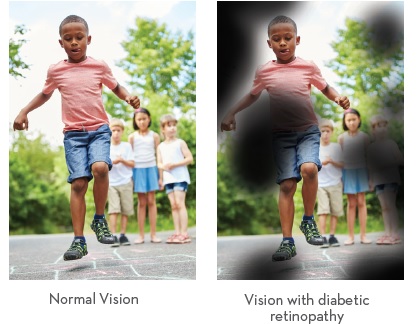
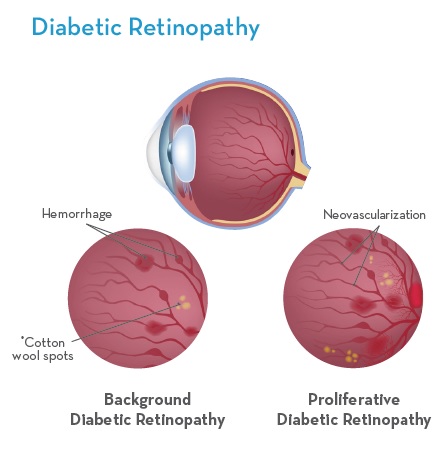
糖尿病視網膜病變是糖尿病的並發症(I型和II型)。 這是由於高血糖水平無法控制時,視網膜中光敏組織的血管受損造成的。
由於II型糖尿病的患病率繼續上升,糖尿病人群因糖尿病視網膜病變而進行營養干預的市場機會不斷擴大。
I型和II型糖尿病
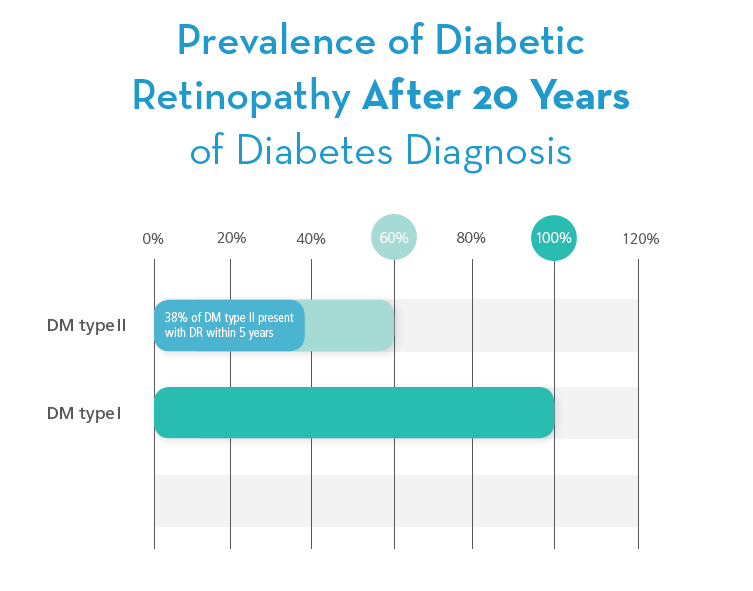
I型糖尿病患者在糖尿病前3-5年或青春期前視網膜病變罕見。 在接下來的二十年中,幾乎所有的I型糖尿病患者都會出現視網膜病變。 預計到2050年在美國將有500萬人患有I型糖尿病。II型糖尿病約佔所有確診糖尿病病例的90%至95%。 在診斷後的5年內,64歲以上的30歲以上的II型糖尿病患者患有糖尿病視網膜病變。3
了解Omegas營養的不平衡
奧米加-3同奧米加-6 脂肪酸屬於所謂嘅「必需脂肪酸」。人體嘅構造當中,好需要呢啲脂肪酸嚟維持唔同嘅 機能,包括製造健康嘅細胞,以及維護眼部健康等等。由於人體唔識得自我製造呢啲必需脂肪酸,要吸取呢 啲營養就必須透過食物。現代人嘅食材裏面,含有植物油、飽和脂肪同埋其他快餐類食品,都含有豐富嘅嘅 奧米加-6;相對地,我哋對奧米加-3脂肪酸嘅每日吸取量就少之又少。好多科學研究已經證明,奧米加-3脂 肪酸係維持健康身體嘅必須營養之一。
我們的身體是慣常接受最佳的營養 – 歐米茄-6和歐米茄-3比例幾乎1:1。 研究已經證實,最近人們的飲食習慣已經遠遠超過這個比率。3 保持PUFA的這種平衡被認為是必要的營養成分為我們的一般健康和維持細胞膜內的穩態來打開或關閉炎症級聯作為生理上的必要.4
糖尿病影響負責產生消化食物所需酶的胰腺。營養數據顯示早在1943年糖尿病患者的胰腺功能下降.1 當胰島素的作用在20世紀初確立時,醫生意識到糖尿病患者也患有營養不良。
懷疑糖尿病患者的胰腺消化功能可能降低,促使調查胰腺功能的外分泌功能.1 最近的研究證實,多達74%的糖尿病患者消化吸收脂肪的能力受損進一步增加了PUFAs不平衡或缺乏的營養影響.1 提供EPA和DHA必需脂肪酸的生物可利用形熊是解決這一缺陷所必需的。
糖尿病影響負責產生消化食物所需酶的胰腺。 最近的研究繼續證實,多達74%的糖尿病患者俱有消化吸收脂肪的能力受損。
Omega-3s(EPA / DHA)和糖尿病視網膜病變
當高血糖水平沒有管理時,視網膜中光敏組織的血管受損導致糖尿病視網膜病變。這種糖尿病引起的視網膜微血管損傷導致糖尿病性視網膜病的血管病變,並最終導致視力喪失.5 有幾個階段的視網膜血管變性,所有這些階段已被證明有益於引入Omega-3s EPA / DHA納入治療方案。
在身體中發現的最高濃度的Omega-3之一;特別是DHA,在視網膜中。同行評審的數據支持了Omega-3s EPA / DHA的營養需求,以防止已經存在的Omega-3脂肪酸缺乏型糖尿病患者發生糖尿病視網膜病變並阻止其發展.15i美國國立衛生研究院(NIH) )支持營養干預作為治療。研究人員發現,在小鼠的飲食中增加ω-3脂肪酸和降低ω-6脂肪酸減少了血管損失的面積,最終導致可能導致失明的異常血管的生長。 ω-6脂肪酸進一步促進視網膜中異常血管的生長。研究表明,含有較高量Omega-3的小鼠視網膜病變的各個階段下降近50%
早期的Omega-3脂肪酸介入糖尿病視網膜病變也有文獻報導富含DHA的飲食可完全預防視網膜血管病變,導致視網膜炎症伴隨抑制和細胞功能矯正.16
PREDIMED隨機臨床試驗的一項次級研究的數據來自一項觀察性縱向隊列分析,僅考慮2型糖尿病患者的基線水平,在6年的中位隨訪結果顯示,那些報告至少500 /與未達到Omega-3目標攝入量的那些人相比,每天攝入基線長鏈Omega-3(EPA / DHA)的人每天攝入視覺威脅性糖尿病視網膜病的風險降低46%。此外,高血壓患者,糖尿病患者5年以上和基線胰島素治療患者的風險降低程度更高.17
在體內發現的最高濃度的Omega-3之一; 特別是DHA,在視網膜中。 同行評審的數據豐富了Omega-3s EPA / DHA作為一種醫療食品的營養需求,以防止已發生Omega-3脂肪酸缺乏的糖尿病患者發生DR並阻止DR的進展.15i
目前,糖尿病視網膜病變晚期治療模式的護理標準是侵入性的,昂貴的並且限於激光照片凝固和/或玻璃體內註射血管內皮生長因子(VEGF)抑製劑/類固醇。晚期糖尿病視網膜病變患者也可受益於EPA / DHA治療,如兩年隨機單盲對照試驗所示。這項研究跟踪了兩組糖尿病性黃斑水腫(DME)患者
第一組單獨接受玻璃體內雷珠單抗;第二組接受口服DHA / EPA(1,050mg / 127mg天)以及每月一次的雷珠單抗治療四個月,隨後進行蘭尼單抗的根治治療。
與單獨注射相比,Ranibizumab加補充劑可減少中心亞區黃斑厚度.18ii此外,補充組在12個月時也有顯著的Omega-6花生四烯酸水平下降,24個月時與基線相比顯著下降.18iii同時,在觀察到歐米伽-6與歐米茄-3比例降低的相似模式.18iv作者稱,“在二甲醚的患者中使用玻璃體內雷珠單抗和DHA補充劑廣泛適用於日常臨床實踐”.18v
進展的危險因素一旦出現視網膜病,在預測視網膜病早期至晚期病情發展過程中,糖尿病的病程似乎不如血糖控制。[19]高血壓的強化治療可能會減緩視網膜病變的進展,但數據仍然不確定。大量研究表明,血脂管理可能會減少視網膜病變進展和治療需求.20因此,眼科醫生應該鼓勵患有糖尿病的患者盡可能符合他們疾病的所有醫療和營養方面的治療。
護理管理
驗光師和眼科醫生都會接受初級保健醫師以及只進行驗光的驗光師的糖尿病推薦;然而,當有晚期非增殖性糖尿病視網膜病變(NPDR),增殖性視網膜病變(PDR)或黃斑水腫(ME)時,需要轉診至眼科醫生。轉診至視網膜專科醫生在NPDR的疾病管理中各不相同,但通常在PDR發展之前提及。
糖尿病視網膜病變的護理過程包括病史,定期眼科檢查或篩查未曾接受過糖尿病視網膜病變或其他眼病治療的患者的高質量視網膜照片,以及定期隨訪。有效的篩查方案的目的是確定誰需要轉診給眼科醫生進行密切隨訪和可能的治療,以及誰可以每年進行篩查。應鼓勵II型糖尿病無糖尿病視網膜病變的患者每年進行一次擴張眼檢查以檢測糖尿病視網膜病變的發病。沒有糖尿病視網膜病變的I型糖尿病患者應該在糖尿病發病5年後開始年度擴張眼科檢查。對於糖尿病患者的第一次眼科檢查和隨後的隨訪檢查的建議時機各不相同。
應鼓勵II型糖尿病無糖尿病視網膜病變的患者每年進行一次擴張眼檢查以檢測糖尿病視網膜病變的發病。
患者結果標準:
•改善或穩定視覺功能
•改善或穩定視力相關的生活質量
•通過與患者的初級保健醫生就糖尿病視網膜病變的狀態和最佳代謝控制需求進行密切溝通,對葡萄糖,血壓和其他風險因素進行最佳控制
References:
1. Alterations in Exocrine Pancreatic Function in Diabetes mellitus. The Pancreapeia Version 1.0, February 16, 2015.
2. Omega-3 Fatty Acids Protect Eyes Against Retinopathy, Study Finds. National Institutes of Health(NIH) Archived Report, June 24, 2007.
3. Retinopathy in Diabetes; Donald S. Fong, MD, MPH, et al American Diabetes Association Diabetes Care 2004 Jan; 27(suppl 1): s84-s87.
What is Diabetic Retinopathy, American Academy of Ophthalmology Kierstan Boyd, March 1, 2017 Diabetic Retinopathy, American Academy of Ophthalmology Preferred Practice Pattern, 2014.
2,5,6. CDC, 2016 Report, Diabetes.
3. Evolutionary aspects of diet, essential fatty acids and cardiovascular disease. Eur Heart J Supplements, Vol. 3 (Suppl D) June 2001.
4. Handbook of Diet, Nutrition and the Eye 2014. Edited by Victor R. Preedy. Chapter 17.3 Composition of skin lipids, P. viola, F. Nobili and M. Viola.
5. N-3 Polyunsaturated Fatty Acids Prevent Diabetic Retinopathy by Inhibition of Retinal Vascular Damage and Enhanced Endothelial Progenitor Cell Reparative Function PLoS One. January 2013, Vol. 8 Issue.
4. WebMD Medical Reference. January 2017, American Diabetes Assoc.
9. An Increase in the Omega-6/Omega-3 Fatty Acid Raio Increases the Risk for Obesity. Nutrients 2016, 8, 128 page 3, paragraph 1, sentence 1.
10. The Omega-3 Effect 2012, page 162.
11. Can adults adequately convert alpha-linolenic acid (18:3m-3) to eicosapentaoenoic acid (20:5n-3) and docosahexaenoic acid (22:6n-3)? Int J Vitam Nutr Res. 1998;68(3):159-73.
12. The Omega-3 Effect 2012, page 162, paragraph 2, sentence 3.
13.
15. Omega-3 Fatty Acids Protect Eyes Against Retinopathy, Study Finds. National Institutes of Health(NIH) Archived Report, June 24, 2007.
16. N-3 Polyunsaturated Fatty Acids Prevent Diabetic Retinopathy by Inhibition of Retinal Vascular Damage and Enhanced Endothelial Progenitor Cell Reparative Function PLoS One. January 2013, Vol. 8 Issue.
17. Dietary Marine omega-3 fatty acids and Incident Sight-Threatening Retinopathy in Middle-Aged and Older Individuals with Type 2 Diabetes. JAMA Ophthalmol. Published online August 18, 2016.
18. Combined Intravitreal Ranibizumab and Oral Supplementation with Docosahexaenoic Acid and Antioxidants for Diabetic Macular Edema. Retina 0:1-10, 2016.
19. Klein R, Sharrett AR, Klein BE, et al. The association of atherosclerosis, vascular risk factors, and retinopathy in adults with diabetes: the atherosclerosis risk in communities study. Ophthalmology 2002;109:1225-34.
20. Van Leiden HA, Dekker JM, Moll AC, et al. Blood pressure, lipids, and obesity are associated with retinopathy: The Hoorn Study. Diabetes Care 2002;25:1320-5.
21. Bioavailability of marine n-3 acid formulations, Prostaglandins Leukotrines Essent. Fatty Acids (2010), doi: 10.1016/j.plefa.2010.06.007.
